Ficha temática
ASIGNATURA: Química II
UNIDAD 2. Alimentos, proveedores de sustancias esenciales para la vida
Aprendizajes esperados:
- Identifica en las fórmulas de compuestos del carbono, los grupos funcionales que caracterizan a los alcoholes, aldehídos, cetonas, ácidos carboxílicos, ésteres, aminas y amidas. (N1)
- Da ejemplos de compuestos orgánicos importantes por sus aplicaciones prácticas.
- Señala que el tipo de elemento y de enlace, el tamaño y forma de las cadenas y los grupos funcionales presentes, son los factores que determinan las propiedades de los compuestos orgánicos. (N2)
- Reconoce la importancia de la posición de los átomos en las moléculas mediante la elaboración de modelos estructurales. (N2)
- Aumenta su capacidad de abstracción al elaborar modelos tridimensionales de moléculas sencillas de alcoholes, aldehídos, cetonas, ácidos carboxílicos, ésteres, aminas y amidas.
CRÉDITOS
Colegio de Ciencias y Humanidades
- Rosa Elba Pérez Orta Antonio Rico Galicia Elaboración de contenidos
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
- José Fernando García Pacheco Yessica Gisela Arredondo Guzmán Desarrollo de sistemas
- Elizabeth Ortiz Caballero Diseño gráfico
- Lourdes Marcela Peña Lartigue Apoyo a diseño gráfico
- Rebeca Valenzuela Argüelles Coordinación de diseño didáctico
- Mario Alberto Hernández Mayorga Coordinación del desarrollo
- Teresa Vázquez Mantecón Coordinación del proyecto
Bibliografía
- autor. (año). título. país: editorial.

¿Por qué algunos alimentos tienen un aroma característico? ¿Qué relación existe entre el aroma de
una fruta y el principio activo de un medicamento? ¿Por qué se usa alcohol para limpiar heridas o
gasolina blanca para remover manchas de grasa? ¿Qué propiedades poseen los compuestos del
carbono de ciertos materiales o productos comerciales que nos permiten darles un uso o aplicación
específica? Para dar respuesta a estas interrogantes se requiere conocer la estructura de los
compuestos del carbono.
Existen algunos tipos de compuestos del carbono como los alcoholes, aminas, aldehídos, cetonas,
ácidos carboxílicos, ésteres y amidas, que se consideran derivados de los
hidrocarburos
x
Compuestos formados sólo por átomos de carbono y de hidrógeno.
y se
caracterizan por tener en su estructura átomos de carbono enlazados a átomos de otros elementos
como oxígeno y nitrógeno, formando parte de un grupo funcional, el cual le asigna propiedades
específicas.
Así, productos de uso cotidiano como el vinagre, saborizantes para alimentos, acetona, anticongelante, colorantes, ciertos medicamentos, lacas para madera, entre muchos otros, tienen componentes orgánicos con propiedades, usos o aplicaciones relacionados con el grupo o grupos funcionales que contienen en su estructura.
| ALCANO | ESTRUCTURA | RADICAL | ESTRUCTURA |
|---|---|---|---|
| Metano | CH4 | Metilo | -CH3 |
| Etano | CH3CH3 | Etilo | -CH2-CH3 |
| Propano | CH3CH2CH3 | N-propilo | -CH2-CH2-CH3 |
| Butano | CH3CH2CH2CH3 | N-butilo | -CH2-CH2-CH2-CH3 |
| Pentano | CH3CH2CH2CH2CH3 | N-pentilo | -CH2-CH2-CH2-CH2-CH3 |
-
Alcohol
HidroxiloOH
-
Aldehido y Cetona
CarboniloO C
-
Ácido carboxílico
CarboxiloO C O H
-
Éster
ÉsterO O C
-
Amina
AminoN
-
Amida
AmidaO N H C H
Volvamos a las preguntas que se plantearon al principio de este bloque: ¿por qué algunos alimentos tienen un aroma característico? ¿Qué relación existe entre el aroma de una fruta y el principio activo de un medicamento? ¿Por qué se usa alcohol para limpiar heridas o gasolina blanca para remover manchas de grasa? ¿Qué propiedades poseen los compuestos del carbono de ciertos materiales o productos comerciales que nos permiten darles un uso o aplicación específica? La respuesta se encuentra en la estructura de los compuestos del carbono que señala el tipo de elemento y de enlace, el tamaño y forma de las cadenas y los grupos funcionales presentes. Estos factores determinan las propiedades de los compuestos orgánicos.
La polaridad x Es una propiedad de las moléculas que se refiere a la distribución de las cargas eléctricas. La zona en la que se encuentren más electrones resultará con una carga parcial negativa y la zona con menos electrones tendrá una carga parcial positiva. del grupo hidroxilo provoca que estos compuestos sean solubles en agua y al ir aumentando el tamaño de la cadena hidrocarbonada del alcohol se modifican sus propiedades características, como su solubilidad en agua.
El grupo hidroxilo puede estar en diversas posiciones en un alcohol e incluso puede haber dos o más para formar los denominados polialcoholes.
| Ejemplos | Propiedades | Usos y aplicaciones |
|---|---|---|
|
Metanol
CH3
OH
|
Se conoce como alcohol de madera y es el más sencillo. Es tóxico y provoca ceguera, por lo que es necesario tener cuidado con las bebidas adulteradas pues posiblemente contienen metanol. Sus usos son variados; se utiliza como disolvente, en pinturas, para lacas, como combustible, materia prima para fabricar aditivos para autos, adhesivos, fibras y plásticos. |

|
|
Etanol
CH3
CH2
OH
|
Está presente en bebidas alcohólicas como la cerveza, el vino y el licor, en aditivos para gasolina y combustible bioetanol. x El etanol es un compuesto químico obtenido a partir de la fermentación de los azúcares y puede utilizarse como combustible, ya sea solo o mezclado en cantidades variadas con gasolina. Su uso se ha extendido principalmente para reemplazar el consumo de derivados del petróleo. El bioetanol tiene las mismas características y composición química que el etanol, ya que se trata del mismo compuesto. La diferencia radica en su proceso de producción. El bioetanol se obtiene a partir de biomasa, no del petróleo. Es un excelente disolvente que se utiliza en perfumes, medicinas y saborizantes, como antiséptico, componente de productos para la limpieza de la piel y disminución de la fiebre. Puede causar coma o muerte si se ingiere en grandes cantidades. |

|
|
Propanotriol o glicerina
OH
OH
OH
CH2
CH
CH2
|
Se conoce como glicerina, es humectante, se utiliza en ungüentos, medicinas, cosméticos, pasta de dientes, dulces, adhesivos, tratamiento de cuero y para fabricar dinamita. |

|
|
1,2-etanodiol o etilénglicol
OH
OH
CH2
CH2
|
Es el componente principal del anticongelante para automóviles. |
|
| Número de átomos | Prefijos |
|---|---|
| uno | met |
| dos | et |
| tres | prop |
| cuatro | but |
| cinco | pent |
| seis | hex |
| siete | hept |
Si el grupo -OH se encuentra en otra posición que no sea en un extremo de la cadena, se numera ésta a partir del lado más cercano al grupo funcional, al nombrarlo se indica su posición:
Son muy reactivos debido a la presencia del grupo carbonilo y poseen olores característicos. Al modificar los sustituyentes unidos al grupo funcional cambian sus propiedades, por ejemplo, su estado físico.
| Ejemplos | Propiedades | Usos y aplicaciones |
|---|---|---|
|
Metanal o Formaldehído
O
H
C
H
|
Gas de olor penetrante, venenoso para las bacterias por lo que se usa como desinfectante y antiséptico y para la preparación de polímeros como la baquelita. x Resina sintética que se obtiene al reaccionar fenol y formaldehído. Patentado en 1907, fue el primer plástico termoestable, aislante y resistente al agua, a los ácidos y al calor. En disolución acuosa al 40% se le conoce como formol, que se utiliza para embalsamar y conservar especímenes biológicos. |

|
|
Etanal o Acetaldehído
O
CH3
C
H
|
Se utiliza para fabricar compuestos orgánicos como el ácido acético y acetato de etilo, que se emplea en la producción de perfumes, colorantes, plásticos y caucho sintético. |

|
|
Benzaldehído
H
C
O
|
Cuando el grupo aldehído está unido a un benceno (arilo) se obtiene un compuesto conocido como aceite esencial de almendra (sintético), se emplea como ingrediente de saborizantes y fragancias, y se encuentra presente en frutas como el higo. |

|
| Número de átomos | Prefijos |
|---|---|
| uno | met |
| dos | et |
| tres | prop |
| cuatro | but |
| cinco | pent |
| seis | hex |
| siete | hept |
Para dos átomos de carbono:
Para tres átomos de carbono:
Debido a la presencia del grupo carbonilo, las cetonas son químicamente reactivas como en el caso de los aldehídos; también poseen olores característicos. Al ir aumentando las cadenas hidrocarbonadas unidas al grupo carbonilo, cambian sus propiedades, como en el caso de su solubilidad.
| Ejemplos | Propiedades | Usos y aplicaciones |
|---|---|---|
|
Propanona o Acetona
O
CH3
C
CH3
|
Es un líquido transparente e incoloro, de olor agradable pero penetrante y es soluble en agua. Se usa como removedor de esmalte para uñas y es un buen disolvente de grasas, barnices y ciertos materiales de caucho. |

|
|
Etilmetilcetona o Butanona
O
CH3
C
CH2
CH3
|
Se utiliza en pinturas, adhesivos y otros acabados porque se evapora rápidamente y se disuelve en muchas sustancias. Es un producto natural de ciertos árboles y se encuentra en algunas frutas y vegetales. |

|
1,7,7-trimetilbiciclo
[2,2,1]heptan-2-nona
o Alcanfor
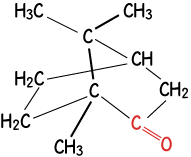
|
Soluble en solventes no polares como el benceno, de olor fuerte y penetrante. Antimicrobial, bálsamo, anestésico local, ingrediente activo de ungüentos. |

|
| Número de átomos | Prefijos |
|---|---|
| tres | prop |
| cuatro | but |
| cinco | pent |
| seis | hex |
| siete | hept |
Los ácidos carboxílicos de baja masa molecular son solubles en agua, propiedad que disminuye al aumentar dicho valor; por lo general son de olor desagradable y al combinarse con metales forman sales metálicas.
| Ejemplos | Propiedades | Usos y aplicaciones |
|---|---|---|
|
Ácido metanoico, o ácido fórmico
H
COOH
|
Se encuentra en la naturaleza, en la miel, en las frutas y en la picadura de hormigas. En apicultura es utilizado en el control de parásitos, también se emplea en la industria química para la fabricación de tintes. |

|
|
Ácido etanoico o ácido acético
CH3
COOH
|
Líquido, incoloro, de olor irritante y sabor ácido. Es miscible x Que se puede mezclar completamente con un líquido. con numerosos disolventes orgánicos y en disolución acuosa actúa como ácido débil; las disoluciones de baja concentración (de 4 a 8%) preparadas a partir del vino, sidra o malta constituyen lo que conocemos como vinagre. |

|
|
Ácido butanoico o ácido butírico
CH3
CH2
CH2
COOH
|
Es una de las sustancias de olor más desagradable que se pueda imaginar, se encuentra presente en la mantequilla rancia. Los quesos fuertes contienen pequeñas cantidades de este compuesto. |

|
| Número de átomos | Prefijos |
|---|---|
| uno | met |
| dos | et |
| tres | prop |
| cuatro | but |
| cinco | pent |
| seis | hex |
| siete | hept |
Para dos átomos de carbono:
Los ésteres poseen aromas fuertes y son volátiles, dan sabor y olor a muchas frutas; además, son los constituyentes mayoritarios de las ceras animales y vegetales. Se usan como esencias artificiales de frutas en la industria alimenticia, bebidas y dulces. También se emplean como disolventes de numerosas sustancias orgánicas.
| Ejemplos | Propiedades | Usos y aplicaciones |
|---|---|---|
|
Etanoato de etilo o acetato de etilo
O
CH3
C
O
CH2
CH3
|
Disuelve hidrocarburos, cetonas y alcoholes. Se emplea como disolvente de pinturas de óleo. |

|
|
Butirato de metilo
O
CH3
CH2
CH2
C
O
CH3
|
Se emplea en la industria alimenticia en la producción de bebidas sabor a manzana. |

|
|
Butirato de etilo
O
CH3
CH2
CH2
C
O
CH2
CH3
|
Se emplea en la industria de alimentos y bebidas para dar sabor a piña. |

|
| Número de átomos | Prefijos |
|---|---|
| uno | met |
| dos | et |
| tres | prop |
| cuatro | but |
| cinco | pent |
| seis | hex |
| siete | hept |
Para dos átomos de carbono y el radical metilo:
Sirven como disolventes, catalizadores x Materiales que aumentan la rapidez de una reacción química sin consumirse. y lubricantes x Materiales que impiden la fricción entre dos piezas. sintéticos. Se utilizan en la industria de cosméticos, textiles y fotográfica; para elaborar tintes del cabello, como antioxidante del caucho y en suavizantes de ropa. Muchas de ellas se emplean en la fabricación de herbicidas, pesticidas y colorantes. Son ejemplos:
| Ejemplos | Propiedades | Usos y aplicaciones |
|---|---|---|
|
Metilamina
CH3
NH2
|
Se utiliza como acelerador para reveladores fotográficos. |

|
|
Dietilamina
CH3
CH2
NH
CH2
CH3
|
Se utiliza como inhibidor x Material que disminuye la rapidez de una reacción química sin consumirse. de la corrosión x Deterioro de los metales por ataque electroquímico del entorno. de metales en la industria metalúrgica y como disolvente en la industria del petróleo. |

|
|
1-fenilpropan-2-amina o anfetamina
CH3
CH2
CH
NH2
|
Tienen un efecto estimulante en el sistema nervioso central y se utiliza como un medicamento. |
|
En la naturaleza se presentan en forma de polímeros x Molécula grande formada por muchas unidades pequeñas que se repiten, llamadas monómeros. denominados poliamidas y se encuentran en las proteínas naturales como la lana, la seda o las telarañas; también pueden ser sintéticas como el nylon. Estas macromoléculas x Son moléculas que tienen una masa molecular elevada, formadas por un gran número de átomos. Generalmente se pueden describir como la repetición de una o unas pocas unidades mínimas, los monómeros, formando los polímeros. se forman utilizando como puente enlaces tipo amida –CONH-.
| Ejemplos | Propiedades | Usos y aplicaciones |
|---|---|---|
|
Carbonildiamida Urea
NH2
O
C
NH2
|
Es un sólido cristalino e incoloro. Se encuentra abundantemente en la orina. La síntesis industrial de la urea se obtiene a partir del amoníaco (NH3) y dióxido de carbono (CO2). Se emplea frecuentemente como fertilizante. |

|
|
imino (1,6 dioxo-hexanediil)
iminohexanediil
PoliamidaNylon 6,6
...
O
H
H
...
O
C
( C H
2 )4
C
N
( C H
2 )6
N
...
|
Se utiliza en la confección de tejidos y cerdas, en la fabricación de diversos utensilios, engranajes, poleas, ruedas y partes de válvulas por su durabilidad y resistencia. |

|
Componente en
medicamentos:
N-(4-hidroxifenil) etanamida
o acetaminofén
|
El grupo amida se encuentra en la estructura de principios activos como el acetaminofén (Paracetamol), que junto con los grupos arilo e hidroxilo le asignan propiedades que permiten utilizarlo como un analgésico y antipirético (reduce la fiebre). |

|
Alcanos: Hidrocarburos saturados formados sólo por átomos de carbono e hidrógeno unidos entre sí por enlaces sencillos. Su fórmula general es CnH2n+2 .
Arilo: Radical aromático, se obtiene cuando el benceno pierde uno de sus hidrógenos (C6H5-)
Baquelita: Resina sintética que se obtiene al reaccionar fenol y formaldehído. Patentado en 1907, fue el primer plástico termoestable, aislante y resistente al agua, a los ácidos y al calor.
Bioetanol: El etanol es un compuesto químico obtenido a partir de la fermentación de los azúcares y puede utilizarse como combustible, ya sea solo o mezclado en cantidades variadas con gasolina. Su uso se ha extendido principalmente para reemplazar el consumo de derivados del petróleo. El bioetanol tiene las mismas características y composición química que el etanol, ya que se trata del mismo compuesto. La diferencia radica en su proceso de producción. El bioetanol se obtiene a partir de biomasa, no del petróleo.
Catalizadores: Materiales que aumentan la rapidez de una reacción química sin consumirse.
Corrosión: Deterioro de los metales por ataque electroquímico del entorno.
Divalente: Que posee una valencia de dos, es decir, forma dos enlaces al combinarse con otros átomos.
Electronegatividad: Capacidad de un átomo para atraer los electrones hacia él en un enlace químico.
Enlaces Covalentes: El enlace covalente se presenta cuando dos átomos quedan unidos al compartir un par de electrones.
Estructura: Es la manera cómo están unidos y orientados espacialmente los átomos en cada molécula de una sustancia.
Fórmula Estructural: La fórmula estructural o desarrollada, representa la manera en que los átomos de una molécula están conectados y arreglados en el espacio. Los enlaces entre los átomos se señalan utilizando guiones.
Fórmula semidesarrolladas: Muestra los átomos de hidrógeno enseguida de los átomos de carbono al que están unidos. No se indican todos los enlaces simples, únicamente enlaces C—C.
Hidrocarburos: Compuestos formados sólo por átomos de carbono y de hidrógeno.
Inhibidor: Material que disminuye la rapidez de una reacción química sin consumirse.
IUPAC por sus siglas en inglés (International Union of Pure and Applied Chemistry): Es una organización no gubernamental internacional dedicada al estudio de la química pura y aplicada. Tiene como miembros a las sociedades nacionales de química de casi todos los países del mundo. Es la autoridad reconocida en el desarrollo de normas para la denominación de los compuestos químicos, mediante su Comité Interdivisional de Nomenclatura y Símbolos.
Lubricantes: Materiales que impiden la fricción entre dos piezas.
Macromoléculas: Son moléculas que tienen una masa molecular elevada, formadas por un gran número de átomos. Generalmente se pueden describir como la repetición de una o unas pocas unidades mínimas, los monómeros, formando los polímeros.
Miscibles: Que se puede mezclar completamente con un líquido.
Monovalente: Que posee una valencia de uno, es decir, forma un enlace al combinarse con otro átomo.
Polaridad: Es una propiedad de las moléculas que se refiere a la distribución de las cargas eléctricas. La zona en la que se encuentren más electrones resultará con una carga parcial negativa y la zona con menos electrones tendrá una carga parcial positiva.
Polímero: Molécula grande formada por muchas unidades pequeñas que se repiten, llamadas monómeros.
Tetravalente: Que posee una valencia de cuatro, es decir, forma cuatro enlaces al combinarse con otros átomos.
Trivalente: Que posee una valencia de tres, es decir, forma tres enlaces al combinarse con otros átomos.
Es un div con la clase ventana. Si no tiene un elemento con la clase btn-close se le agrega uno
adasdasdasdadas
Bibliografía
American Chemical Society, QuimCom. Química en la Comunidad. (1993) Pearson Educación México,
American Chemical Society, Chemestry in context. (1993), W.M.C. Brown Publisher. USA
Burns, F. A., Fundamentos de química. (2003) Pearson Educación. México.
Chang, R., Química, Colombia, Mc Graw Hill, 2002.
Fox, M.,Química Orgánica, Pearson Educación (2000) Addison WesleyLongman, S. A., de C.V. Segunda edición. México
García, M., et al. Guía para el Profesor de Química II en el CCH. (2007) CCH-UNAM. México
Gómez, J., et al. Manual de Química II, CCH Azcapotzalco. México.
Martínez, A., y Castro, C., Química. (2007) Preuniversitario Santillana, México.
Pimentel, G. C., Química una ciencia experimental. (1972) Editorial Reverté S.A. España.
Rico, A., Pérez, R., Segundo Curso Química para estudiantes del bachillerato del CCH. (2011) CCH-UNAM. México.
Seminario de Química de Naucalpan, Guía para el profesor de Química II, CCH Plantel Naucalpan, 2010.
Zumdahl, S., Fundamentos de química, China, Mc Graw Hill, 2007.
Ciberografía
http://rakukeireiki.ning.com/profiles/blog/show?id=3103717%3ABlogPost%3A585077&commentId=3103717%3AComment%3A592289&xg_source=activity
http://www.cositasfemeninas.com/dieta-de-la-gelatina.html
http://www.cdxetextbook.com/procedures_sp/refillcoolSP.html
http://www.bazaraurorita.com/anilina-aaa-p-246.html?zenid=1642ebac082b80ab08116e5b3f7439fb
http://pruebas.publicar.com/elsalvador/amadafuentes/laboratoriossym/productos1.html
http://laciudadatomica.blogspot.com/2011_02_25_archive.html
http://www.bricolajeydecoracion.com/como-aplicar-laca-para-madera/
http://gybuquimicaorganica.wikispaces.com/7.+Alcoholes
http://es.wikipedia.org/wiki/Formaldeh%C3%ADdo
http://ricardi.webcindario.com/quimica/comqui.htm
http://www.alonsoformula.com/organica/mol46.htm
http://es.wikipedia.org/wiki/Etanoato_de_etilo
http://es.wikipedia.org/wiki/Metilamina
http://mx.selecciones.com/contenido/a1379_mejores-formas-de-barnizar
http://almachejo.blogspot.com/
http://sertino.blogspot.com/2011/04/elaboracion-de-jabon-de-glicerina.html
Kalipedia.com tarro de formol
http://www.mangensa.com/articulos_detalles.php?articulo_id=74
http://www.centromujer.es/tag/fragancias/
http://laciudadatomica.blogspot.com/2011_02_25_archive.html
http://www.hogarutil.com/bricolaje/taller/herramientas/201109/pegamento-trucos-11680.html
http://maruquita.wordpress.com/2010/11/05/el-antiguo-remedio-con-el-antiguo%C2%A0unguento/
http://www.mascosas.net.eu.org/hormigas.htm
http://www.elpalmardistribuidora.com/productos/?p=869
http://hablandodecocina.com/tag/quesos/
http://comohacerte.com/artesania/pintar-al-oleo-primeros-pasos-tecnicas-de-pintar-al-oleo
http://www.xhnoe.com/2011/Estelares/nota.htm
http://msnlatino.telemundo.com/destacados/Belleza_Y_Estilo/photo_gallery/2011-11/dieta_de_la_pina
http://marinamarabay.wordpress.com/2011/11/29/aplicaciones-de-las-enzimas/
http://www.asometal.org/?p=158
http://www.trainermed.com/docs/nota.php?id=0fd28271c1&titulo=Anfetaminas
http://industriarrocera2010.wikispaces.com/a
http://lomejorcitoendeporte.galeon.com/
Es un div con la clase ventana. Si no tiene un elemento con la clase btn-close se le agrega uno
adasdasdasdadas






