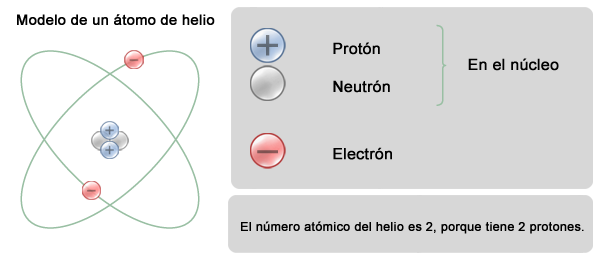
Cada elemento se distingue de los demás por el número de protones que tiene dentro del núcleo.
La cantidad de neutrones o de electrones puede variar sin que el elemento pierda sus propiedades, pero con un protón de más o de menos ese elemento se convertirá en otro distinto.
El número de protones de un elemento se conoce como
número atómico.
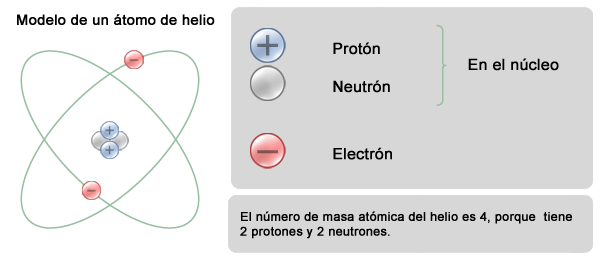
La suma de los neutrones y los protones que se encuentran dentro del núcleo se conoce como número de masa, que no es lo mismo que la masa atómica. Como puedes observar, la masa atómica casi nunca es un número entero. Lo que sucede es que existen átomos de un mismo elemento, conocidos como isótopos, con diferente número de neutrones que por lo tanto tienen un número de masa distinto. El valor que se reporta en la Tabla Periódica es el número de masa promedio de los isótopos de cada elemento, que se conoce como masa atómica.
Otro aspecto importante de notar es que los electrones no influyen en la masa atómica. Recuerda que la masa de un electrón es casi 1850 veces más pequeña que la de un protón, por lo que el núcleo concentra el 99.9 % de la masa del átomo.
Según la teoría más aceptada del origen del universo, la mayoría de los elementos se formaron mediante procesos de fusión nuclear que iniciaron con el Big Bang. Se supone que existía una enorme concentración de partículas elementales, que explotaron liberando una gran cantidad de energía.
El primer elemento que se formó fue el hidrógeno (H), que tiene un sólo protón. Con las temperaturas tan altas que se alcanzaron, los átomos de H se unieron formando átomos de helio (He), que se unieron con otros para formar elementos cada vez más pesados. Este proceso sigue sucediendo en los núcleos de las estrellas jóvenes. En el Sol ya casi no se forman elementos pesados porque su temperatura ha disminuido, pero originalmente se formaron al menos 90, desde el hidrógeno hasta el uranio (U). Al desprenderse la Tierra hace millones de años, estos elementos llegaron a su corteza, con dos excepciones: el tecnecio (Tc) y el prometio (Pm), que si bien no se hallan en la Tierra, sí ha sido posible ubicarlos en algunas estrellas a través de su espectro electromagnético.
Los elementos más pesados que el uranio (U) han sido sintetizados en laboratorios experimentales mediante aceleradores de partículas y procesos de fusión nuclear provocados por el hombre. Algunos de ellos tienen una vida media muy pequeña, de apenas algunos milisegundos.
Desde el punto de vista químico un elemento se considera metal cuando cede fácilmente electrones y no tiene tendencia a ganarlos. Si observas la Tabla Periódica notarás que los elementos metálicos se encuentran acomodados hacia la izquierda, ya que son los que tienen uno, dos o tres electrones en su última capa. Claro, hay una excepción: el hidrógeno (H), porque es un gas y no puede considerarse metal.
Por el contrario, los no metales están ubicados hacia la derecha porque en su última capa tienen seis o siete electrones y tienden a "robarse" los electrones de otros elementos. Evidentemente, los elementos del grupo 18 tienen completa la última capa y no interactúan con otros elementos, ni cediendo ni ganando electrones.
Desde un punto de vista físico, los elementos metálicos presentan brillo, conducen el calor y la electricidad y son maleables.

Observa que algunos elementos están señalados como "semimetales". Lo que pasa es que en ocasiones se comportan como metales, pero bajo ciertas circunstancias no lo hacen. Algunos químicos incluyen en este grupo al astato y otros no.
En la tabla se muestra el estado de agregación de los elementos cuando no están sometidos a temperaturas y presiones extremas. La mayoría se encuentran en estado sólido y existen algunos gases. Sólo hay tres líquidos: el Mercurio (Hg) (cuyo símbolo deriva de la expresión latina
"hydrargyrum" que significa "plata líquida"), el boro (B) y el francio (Fr). Este último es muy inestable: su vida promedio es de 22 minutos antes de convertirse en astato, que es un sólido.
A partir del elemento 104 es muy difícil determinar el estado de agregación. Se trata de elementos sintetizados en laboratorio y sólo se han obtenido cantidades sumamente pequeñas que no permiten determinar con certeza la relación que tendrían sus átomos entre sí. Además, prácticamente no se ven: su vida media es de aproximadamente 0.25 milisegundos.
Las líneas horizontales de la Tabla se llaman periodos. Son 7 y podrás observar que no todos tienen el mismo número de elementos. El periodo 1 únicamente tiene 2, el hidrógeno (H) y el helio (He). En los periodos 2 y 3 existen 8 elementos en cada uno; en los periodos 4 y el 5 hay 18 respectivamente, y cada uno de los periodos 6 y 7 tiene 32 elementos, ya que suman los lantánidos y los actínidos.
En la ilustración se muestra un esquema clásico del átomo según lo describió Niels Bohr en 1913.
Los electrones giran en órbitas alrededor del núcleo y cada una de ellas representa un nivel energético distinto. Actualmente se sabe que en realidad los electrones no se acomodan tan esquemáticamente sino que forman una nube que circunda al núcleo, pero sí es cierto que se acomodan en capas como en una cebolla, cada una de ellas es un nivel energético y en cada nivel caben un número determinado de electrones.
El número de periodo corresponde con el número de niveles energéticos que poseen los átomos de los elementos que ahí se encuentran.
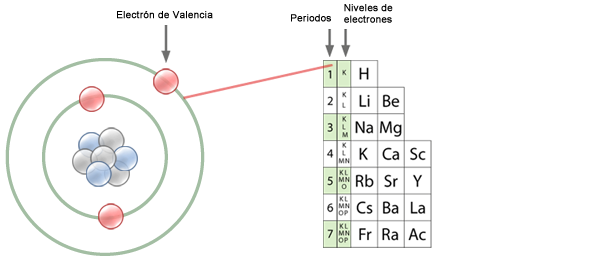
Los electrones de un átomo forman una nube en continuo movimiento alrededor del núcleo, sin embargo este movimiento no es tan caótico como podría pensarse. Los electrones tienden a moverse en zonas que les proporcionan mayor estabilidad; recuerda que son atraídos por el núcleo por la diferencia de carga eléctrica, pero que se repelen entre sí por tener la misma carga.
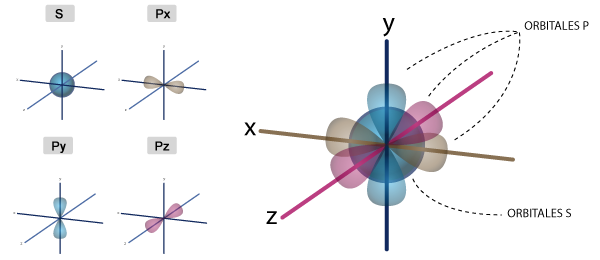
En cada nivel energético se organizan a través de subniveles, y cada uno tiene sus correspondientes orbitales. Un orbital representa una región del espacio donde es más probable encontrar a un par de electrones, ya que siempre tienden a ir en parejas. El orbital más sencillo es el "s", que se supone tiene una forma esférica. Le siguen los orbitales "p", son tres con forma de cacahuate; después están los orbitales "d" que se supone que parecen una flor con cinco pétalos y finalmente los orbitales "f", que serían como una racimo con 7 globos. Evidentemente nadie los ha visto, estas formas se suponen a partir de complicadísimas soluciones a una más complicada ecuación que se llama "de Schroëdinger".
Observa esta tabla para que veas cuántos electrones hay en cada nivel y subnivel:
| 1 |
s |
2 |
| 2 |
s |
2 |
| p |
6 |
| 3 |
s |
2 |
| p |
6 |
| d |
10 |
| 4 |
s |
2 |
| p |
6 |
| d |
10 |
| f |
14 |
Los orbitales de menor energía se llenan primero que los demás. El orden fue establecido por Aufbau y es el siguiente:
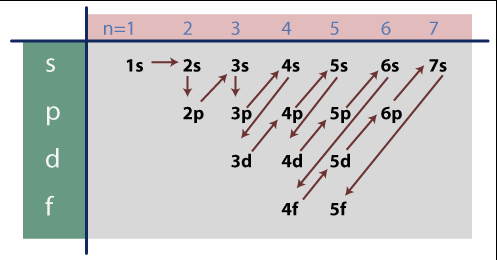
Veamos un ejemplo: la configuración electrónica del potasio, que tiene 19 electrones quedaría así:
1s
2, 2s
2, 2p
6, 3s
2, 3p
6, 4s
1
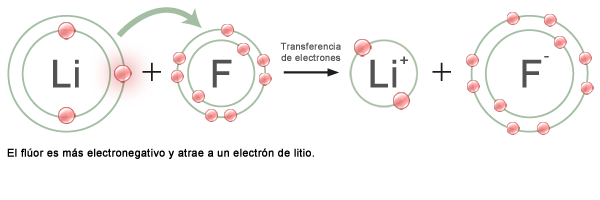
Es la capacidad que tiene un átomo para atraer a los electrones de otro elemento y formar un enlace químico.
La escala con la que se mide fue propuesta por el químico Linus Pauling en 1932. Su rango está entre 4.0, que es la electronegatividad del flúor (F), y 0.7 que es la del francio (Fr).
Como puedes ver, la electronegatividad de los elementos disminuye hacia abajo en cada grupo de la Tabla y también hacia la izquierda en cada periodo.
Un átomo es estable cuando se encuentra en su estado de menor energía. Si no es el caso, se dice que está "excitado" y tiende a regresar a su nivel base. La excitación de un átomo se puede dar a nivel nuclear, cuando hay neutrones de más como en el caso de los isótopos, o a nivel de capas electrónicas, es decir, cuando algunos electrones cambian de un nivel de menor energía a uno mayor. Para regresar a su estado fundamental deben perder energía. Esto se logra a través la emisión de una radiación electromagnética (rayos gamma) o de la emisión de partículas de diferentes tipos (alfa y beta). A este fenómeno se le llama radiactividad.
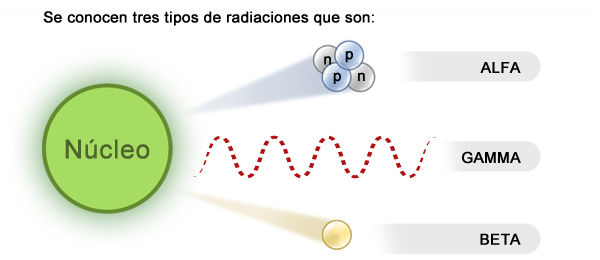
Al final del proceso el átomo radiactivo se transforma en un átomo de naturaleza distinta, es decir, ha experimentado una desintegración. Por ejemplo, el uranio (U) es radiactivo y con el tiempo se va desintegrando hasta convertirse en plomo (Pb). Mientras esto ocurre emite una gran cantidad de radiación alfa, beta y gamma.
A partir del polonio (Po), todos los elementos presentan radiactividad natural. Sólo existen dos elementos radiactivos con número atómico menor al polonio (Po), el tecnecio (Tc) y el prometio (Pm).
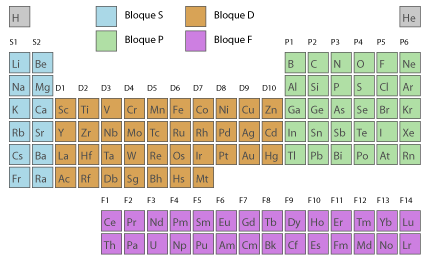
Oficialmente hay 18 grupos en la Tabla Periódica, uno en cada columna. Los elementos que pertenecen a un grupo tienen el mismo número de electrones en su última capa, es decir, los mismos electrones de valencia, que son los que se combinan con los electrones de otros átomos para formar compuestos. Este hecho les da características muy similares, de ahí que muchos de ellos tengan nombres propios: no metales, metales alcalinos, metales alcalinotérreos, alógenos y gases nobles, entre otros.
Las series de lantánidos y actínidos en realidad formarían 14 grupos adicionales, pero se separan de los demás para que la Tabla Periódica no quede demasiado larga y sea más manejable. Observa en la imagen cuántos electrones tiene cada elemento dentro de un mismo grupo en su última capa y en qué tipo de orbital se encuentran.
El 99 % de la masa de cualquier ser vivo está formado por una colección muy pequeña de elementos: carbono (C), hidrógeno (H), oxígeno (O), nitrógeno (N), sodio (Na), magnesio (Mg), potasio (K), calcio (Ca), fósforo (P), azufre (S) y cloro (Cl). Con toda seguridad, este grupo de elementos es esencial para la vida.
De los elementos que están marcados en azul, los químicos y los biólogos no están tan seguros de que sean esenciales, tal vez con la excepción del yodo (I). En los organismos vivos se encuentran en muy poca proporción, apenas algunas trazas y es muy difícil establecer qué pasaría si se suprimieran del todo en un organismo.


 Cada elemento se distingue de los demás por el número de protones que tiene dentro del núcleo.
Cada elemento se distingue de los demás por el número de protones que tiene dentro del núcleo. La suma de los neutrones y los protones que se encuentran dentro del núcleo se conoce como número de masa, que no es lo mismo que la masa atómica. Como puedes observar, la masa atómica casi nunca es un número entero. Lo que sucede es que existen átomos de un mismo elemento, conocidos como isótopos, con diferente número de neutrones que por lo tanto tienen un número de masa distinto. El valor que se reporta en la Tabla Periódica es el número de masa promedio de los isótopos de cada elemento, que se conoce como masa atómica.
La suma de los neutrones y los protones que se encuentran dentro del núcleo se conoce como número de masa, que no es lo mismo que la masa atómica. Como puedes observar, la masa atómica casi nunca es un número entero. Lo que sucede es que existen átomos de un mismo elemento, conocidos como isótopos, con diferente número de neutrones que por lo tanto tienen un número de masa distinto. El valor que se reporta en la Tabla Periódica es el número de masa promedio de los isótopos de cada elemento, que se conoce como masa atómica. Los elementos más pesados que el uranio (U) han sido sintetizados en laboratorios experimentales mediante aceleradores de partículas y procesos de fusión nuclear provocados por el hombre. Algunos de ellos tienen una vida media muy pequeña, de apenas algunos milisegundos.
Los elementos más pesados que el uranio (U) han sido sintetizados en laboratorios experimentales mediante aceleradores de partículas y procesos de fusión nuclear provocados por el hombre. Algunos de ellos tienen una vida media muy pequeña, de apenas algunos milisegundos.
 Observa que algunos elementos están señalados como "semimetales". Lo que pasa es que en ocasiones se comportan como metales, pero bajo ciertas circunstancias no lo hacen. Algunos químicos incluyen en este grupo al astato y otros no.
Observa que algunos elementos están señalados como "semimetales". Lo que pasa es que en ocasiones se comportan como metales, pero bajo ciertas circunstancias no lo hacen. Algunos químicos incluyen en este grupo al astato y otros no.
 A partir del elemento 104 es muy difícil determinar el estado de agregación. Se trata de elementos sintetizados en laboratorio y sólo se han obtenido cantidades sumamente pequeñas que no permiten determinar con certeza la relación que tendrían sus átomos entre sí. Además, prácticamente no se ven: su vida media es de aproximadamente 0.25 milisegundos.
A partir del elemento 104 es muy difícil determinar el estado de agregación. Se trata de elementos sintetizados en laboratorio y sólo se han obtenido cantidades sumamente pequeñas que no permiten determinar con certeza la relación que tendrían sus átomos entre sí. Además, prácticamente no se ven: su vida media es de aproximadamente 0.25 milisegundos.

 Observa esta tabla para que veas cuántos electrones hay en cada nivel y subnivel:
Observa esta tabla para que veas cuántos electrones hay en cada nivel y subnivel: Veamos un ejemplo: la configuración electrónica del potasio, que tiene 19 electrones quedaría así:
Veamos un ejemplo: la configuración electrónica del potasio, que tiene 19 electrones quedaría así:
 Al final del proceso el átomo radiactivo se transforma en un átomo de naturaleza distinta, es decir, ha experimentado una desintegración. Por ejemplo, el uranio (U) es radiactivo y con el tiempo se va desintegrando hasta convertirse en plomo (Pb). Mientras esto ocurre emite una gran cantidad de radiación alfa, beta y gamma.
Al final del proceso el átomo radiactivo se transforma en un átomo de naturaleza distinta, es decir, ha experimentado una desintegración. Por ejemplo, el uranio (U) es radiactivo y con el tiempo se va desintegrando hasta convertirse en plomo (Pb). Mientras esto ocurre emite una gran cantidad de radiación alfa, beta y gamma.