Ficha temática
ASIGNATURA: QUÍMICA III
UNIDAD 2: Reactividad de los componentes del aire
SUBTEMA: Símbolos de Lewis y enlaces covalentes
Aprendizajes esperados:
- Que el alumno relacione la diferencia de electronegatividades para distinguir los tipos de enlace iónico, covalente no-polar y polar.
- Que el alumno represente moléculas, utilizando las estructuras de Lewis y aplique la regla del octeto.
- Que el alumno conozca las características que presentan las moléculas con carácter covalente e iónico.
- Que el alumno identifique el enlace covalente coordinado.
CRÉDITOS
Escuela Nacional Preparatoria
- María Patricia Huerta Ruíz Profesor responsable
- Patricia Peláez Cuate Profesor en colaboración
Dirección General de Cómputo y de Tecnologías de Información y Comunicación
- Pablo Enrique Zenil Rivas Desarrollo de sistemas
- José Enrique Garza González Diseño didáctico
- Laura Méndez Martínez Diseño gráfico
- Mario Alberto Hernández Mayorga Coordinación del desarrollo
- Teresa Vázquez Mantecón Coordinación del proyecto
Bibliografía
- Brown, T., Lemay, E. y Burstein, E. (2004). Química: la ciencia central. México: Editorial Prentice Hall.
- Burns, R. (2011). Fundamentos de química. Quinta Edición. México: Editorial Pearson.
- Chang, R. (2011). Química. Décima Edición. México: Mc Graw Hill Editores.
- Programa de estudios de la asignatura Química III. (1999). México: ENP-UNAM.
- Quílez, J., et al. (2003). Química. Guía del profesorado. España: Editorial ECIR.

Arrastra la lupa sobre la imagen y descubre algunas de las partículas que componen nuestro entorno.
A pesar de que sólo existen 90 elementos químicos de manera natural, tenemos miles y miles de sustancias diferentes. Cada una de ellas resulta de la unión de dos o más átomos acoplados entre sí mediante enlaces químicos.
¿Por qué se combinan los átomos? ¿Qué causas los mantienen unidos en agregados atómicos estables? La explicación propuesta por Gilbert Lewis en 1917 es que los átomos se combinan entre sí para alcanzar una configuración electrónica más estable. La máxima estabilidad se logra cuando un átomo tiene el mismo número de electrones que un gas noble.
Cuando los átomos interactúan para formar un enlace químico, sólo entran en contacto sus regiones más externas, es decir, sus electrones de valencia. Los gases nobles, a excepción del He, tienen ocho electrones en su última capa y, en esencia, eso es lo que la mayoría de los átomos buscarán al enlazarse químicamente con otros átomos.
Cada sustancia tiene ciertas propiedades, algunas compartidas con sustancias parecidas y otras que le dan características especiales y únicas. Las temperaturas de fusión y de ebullición, la solubilidad y la conductividad eléctrica, por ejemplo, dependen de las fuerzas de atracción entre los átomos que los mantienen unidos en las moléculas, es decir, al tipo de enlace químico que hay entre ellos. También dependen del tipo de relación que establecen las moléculas de una sustancia con las de otra sustancia diferente.
Arrastra un átomo de cualquiera de los elementos dentro del recuadro para conocer el tipo de enlace que forma al unirse con el cloro.



Durante la formación de un enlace covalente, dos átomos entrelazan sus nubes electrónicas u orbitales, de tal manera que quedan unidos. La molécula que se forma es más estable que los átomos individuales y no se pueden separar con facilidad.
Ambos átomos, no metálicos, tienen el mismo valor de electronegatividad , 3.0 según la escala de Pauling , es decir son "igual de fuertes" para atraer el electrón del átomo contrario y enlazarse. La diferencia de electronegatividad entre ellos es igual a cero, y al atraerse con la misma fuerza, el par de electrones se comparte equitativamente entre los dos átomos.

Al unirse, los átomos de cloro, comparten un par de electrones para formar una molécula diatómica (Cl2). Este tipo de enlace se llama covalente y como la diferencia de electronegatividad es cero, se denomina no polar, lo que significa que las cargas eléctricas están distribuidas simétricamente alrededor del núcleo.
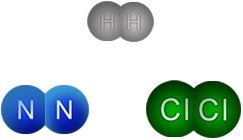
En un enlace covalente polar los electrones se comparten de manera desigual entre átomos de elementos diferentes, como lo hacen los elementos hidrógeno y cloro, dos no metales.

Al ser elementos distintos, sus valores de electronegatividad también lo son: para hidrógeno 2.1 y para cloro 3.0. La diferencia es de 0.9, por lo que el enlace no puede ser iónico. El elemento "más fuerte", es decir, más electronegativo, es el cloro, por lo que los electrones del enlace son atraídos de modo desigual hacia él.
En la molécula de cloruro de hidrógeno los electrones pasan más tiempo cerca del átomo de cloro que del átomo de hidrógeno, encontrándose mayor densidad electrónica cerca de él, por lo que la molécula se polariza, es decir, tiene un polo positivo y otro negativo, parcialmente. El cloro queda con una carga parcial negativa (δ-), mientras el hidrógeno presenta carga parcial positiva (δ+). Por esta razón se llama enlace covalente polar.

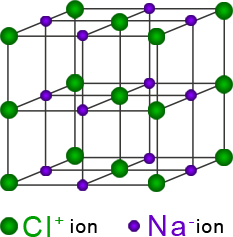
El cloro es un elemento no metálico de alta electronegatividad. Según la escala de Pauling tiene un valor de 3, lo que significa que tiende a ganar electrones. Por el contrario, el sodio, un metal, tiene una electronegatividad baja: 0.9, por lo que su tendencia es a perder electrones. La diferencia de electronegatividad entre ambos es de 2.1.
En general, los metales tienden a perder sus electrones de valencia para formar iones positivos (cationes). Los no metales tienden a ganar electrones para formar iones negativos (aniones). Se dice que un enlace es iónico cuando la diferencia de electronegatividades entre ambos átomos es mayor a 1.7.

Cuando ambos átomos se unen, el elemento “más fuerte”, el cloro, es capaz de arrancar un electrón al sodio. El átomo de sodio forma un ion positivo (Na+) y el átomo de cloro un ion negativo (Cl-). Como se forman iones con cargas eléctricas opuestas hay una atracción de tipo electrostático entre ellos; a esta manera de unirse se le conoce como enlace iónico. Los compuestos iónicos no forman moléculas, forman grandes conglomerados de iones, estructurando redes cristalinas complejas.
Clasifica cada una de las sustancias según el tipo de enlace que presenta. Apóyate con las herramientas para que puedas clasificar correctamente en función de sus propiedades físicas.










| Temperatura de fusión | Conductividad eléctrica | Solubilidad en agua | |
| Sólido | Fundido | ||
El enlace metálico es consecuencia de la facilidad de disociación de los metales en iones positivos y electrones libres. Los metales se componen de un gran número de átomos que forman una malla rodeada por una nube de electrones libres (una macromolécula). Los electrones liberados se desplazan con facilidad de los orbítales de un átomo a los del otro y no están confinados a un par de átomos específicos. Este hecho explica las conductividades eléctricas y térmicas extraordinariamente buenas de los metales.
En las sustancias covalentes hay un compartimiento de electrones entre los elementos no metálicos. Esto hace que formen moléculas con temperaturas de fusión bajas, como por ejemplo CO2, Cl2, O2. También existen redes covalentes con temperaturas de fusión altas como el diamante y los compuestos de silicio SiO2, entre otros. No conducen la corriente eléctrica.
Las sustancias iónicas presentan un intercambio de electrones entre un metal y un no metal; se forman redes iónicas con temperaturas de fusión y ebullición elevadas. Son sólidos y en este estado de agregación no son conductores, sólo lo hacen si están fundidos debido a que los iones que forman la red, se liberan y permiten el flujo de corriente. Son muy solubles en agua y forman disoluciones llamadas electrolitos, que son excelentes conductores de la corriente eléctrica. Algunos ejemplos de estas sales son el cloruro de litio, sulfato de sodio y el yoduro de plata.
| Tipo de sustancia | Temperatura de fusión | Conductividad eléctrica | Solubilidad en agua |
| Metálica | Moderadamente elevadas o muy altas | Alta en el estado sólido ó líquido | Insoluble |
| Iónica | Elevadas | No conducen en estado sólido, pero sí disueltas en agua | Soluble |
| Covalente molecular | Bajas o muy bajas | No conducen | Insoluble excepto el agua |
| Redes Covalentes | Muy elevadas | No conducen | Insoluble |
Lograste ordenar todas las sustancias de acuerdo a su tipo de enlace.
Arrastra la caja de herramientas sobre las sustancias y observa con atención.
¿Cuál es el enlace más común en las sustancias solubles? ¿Qué propiedades comparten las sustancias que tienen enlace covalente atómico? ¿Qué tipo de enlace tienen las sustancias con mejor conductividad y cuál es el de las sustancias con menor temperatura de fusión?
CERRARLa estructura de Lewis es un modelo que facilita la representación de las moléculas que se forman al enlazarse los átomos que las constituyen. Utiliza este modelo para completar las moléculas.
Llena las casillas blancas con los electrones correspondientes y al terminar oprime el botón de verificar. Recuerda que el color indica su pertenencia a un elemento en particular.
El químico norteamericano G. N. Lewis (1875-1946) introdujo la llamada notación de Lewis para representar los átomos y sus enlaces.

En estas estructuras se representan los electrones de valencia de los átomos con puntos alrededor del símbolo, por ejemplo, en el caso del flúor tiene 7 electrones de valencia representados de la siguiente forma:
 |
 |
| Modelo de capas | Modelo de Lewis |
Otros elementos tienen diferente número de electrones de valencia, dependiendo del grupo al que pertenecen.
| Grupo 1 | Grupo 2 | Grupo 3 |
 |
 |
 |
| Grupo 4 | Grupo 6 | Grupo 7 |
 |
 |
 |
Para representar una molécula se colocan los electrones del enlace entre los átomos que lo forman:

Los enlaces pueden representarse mediante guiones colocados entre los dos átomos enlazados, en lugar de los puntos. De esta forma se escriben las fórmulas desarrolladas.

Para representar una molécula se colocan los electrones del enlace entre los átomos que lo forman, por ejemplo en la molécula de flúor, F2, quedaría de la siguiente manera:
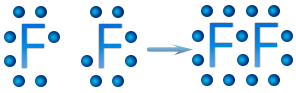
Si los dos átomos de flúor comparten un electrón, ambos tienen 8 electrones en su nivel de valencia, tiene un octeto de valencia y la configuración estable del gas noble neón. Los dos átomos quedan unidos mediante un enlace covalente, al que cada átomo ha contribuido con un electrón.
Cuando un átomo de flúor gana un electrón, al unirse con otro átomo de flúor, lo hace para completar su configuración electrónica, al tener siete electrones de valencia, sólo le falta uno para completar sus ocho electrones y así adquirir la configuración electrónica del neón:


La regla del octeto dice que los átomos tienden a ganar, perder o compartir electrones para adquirir ocho electrones de valencia, esto es, la configuración de un gas noble.
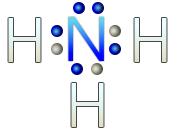
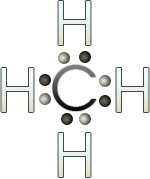
En el caso de la molécula de agua, el oxígeno tiene 6 electrones de valencia, al unirse a los dos hidrógenos, completa su octeto. El hidrógeno no lo hace, ya que el máximo de electrones que tiene en su último nivel es de dos electrones.

Especie química con carga eléctrica, puede ser un átomo o un conjunto de ellos. Por ejemplo: K+, NO3-, Be2+ , CN-, NH4+, entre otros.
Ion que puede tener 1, 2, 3 o más cargas positivas. Por ejemplo: Na+ Ca2+, Al3+, NH4+, entre otros.
Ion que puede tener 1, 2, 3 o más cargas negativas.Por ejemplo: Cl-, CN-, P3-, N5-, PO43-, entre otros.
Es un conglomerado eléctricamente neutro de dos o más átomos unidos por pares compartidos de electrones (enlaces covalentes), que se comporta como una sola partícula. A una sustancia compuesta de moléculas se le llama sustancia molecular.
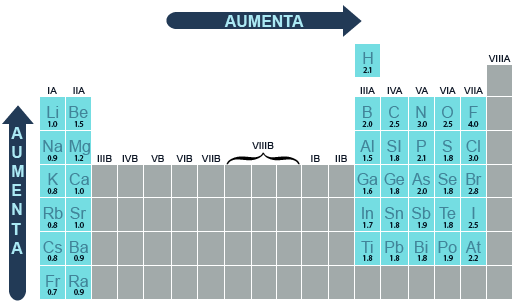
La electronegatividad es una medida de la tendencia que tiene el núcleo de un átomo para atraer los electrones compartidos en un enlace químico. En un periodo de elementos de la tabla periódica, la electronegatividad aumenta con el número atómico. En un grupo, la electronegatividad disminuye a medida que el número atómico o el periodo aumentan.
La tendencia del núcleo de un átomo para atraer los electrones de otro átomo en un enlace químico, conocida como electronegatividad, se mide de acuerdo a la escala de Pauling. Él observó que los átomos mostraban tendencia para formar enlaces y atraer electrones con diferente fuerza. Linus Pauling propuso una escala que va del 0 al 4: asignó el cero a los gases inertes dado que no atraen electrones ni forman enlaces, y el 4 al elemento más electronegativo, el flúor. Los demás valores representan a la fuerza relativa de cada elemento entre esos dos parámetros.