FICHA DIDÁCTICA
Tema:
Tomado del tema ¿Cómo actúa el oxígeno del aire sobre los elementos? perteneciente a la segunda unidad "Oxígeno, componente activo del aire" dentro del programa de estudios de la asignatura Química I del primer semestre del Colegio de Ciencias y Humanidades (CCH-UNAM).
Objetivo:
El alumno distinguirá los metales de los no metales a través de la experimentación, observará las reacciones de las sustancias con el oxígeno y los productos formados con el agua.
Objetivos particulares:
- Formulará y comprobará su hipótesis a través de la experimentación.
- Practicará el uso de material y sustancias del laboratorio de Química.
- Distinguirá los compuestos óxidos, hidróxidos y ácidos.
- Distinguirá los elementos metálicos y no metálicos por su comportamiento frente al oxígeno.
- Clasificará a los óxidos metálicos y no metálicos por los productos de su reacción con agua.
- Comparará los resultados obtenidos de la experimentación con metales y no metales.
CRÉDITOS
- CCH
- Experta en contenido:
- Blanca Estela Quiza Gaytán
- Diseño Instruccional:
- Sergio Meléndez Mercado
- Rocío Angélica Hernández Rodríguez.
- Coordinación del desarrollo:
- Seppe De Vreesse Pieters
- DGTIC
- Diseño Instruccional:
- Lidice Mayari Quevedo Rodríguez
- Rebeca Juárez de la Cruz
- Apoyo a diseño instruccional:
- Viridiana González López
- Diseño gráfico:
- Ivelin Aidee Meza Buenrostro
- Apoyo a diseño gráfico:
- Luis Adrián Márquez Adame
- Animación:
- Antonio Eder Navarro Mendoza
- Desarrollo de sistemas:
- Mario Alberto Hernández Mayorga
- Pablo Enrique Zenil Rivas
- Anibal Jose Cab Salinas
- Erick Leonardo Martínez García
- Coordinación del desarrollo:
- Rebeca Valenzuela Argüelles
- Coordinación del proyecto:
- Teresa Vázquez Mantecón
¡ Bienvenido al laboratorio virtual !
El experimento que realizarás es para conocer el proceso de formación de óxidos metálicos y la reacción de éstos en presencia de agua para sintetizar bases o hidróxidos, así como la formación de óxidos no metálicos y la reacción que ocurre en éstos cuando interactúan con agua en la síntesis de ácidos.
- Medidas de seguridad
- Hipótesis
- Material de trabajo
- Preparación del experimento
- Obtención de óxidos
- Verificación
- Contrastación
- Conclusiones
- Limpieza
Medidas de seguridad
- Bata de laboratorio
- Guantes de neopreno, nitrilo o vinilo
- Lentes de seguridad
- Agua corriente
- Trapo cerca por si hay algún derrame
- No jugar
- No comer
- No contestar celulares
En caso de accidente pide ayuda al profesor, laboratorista o persona a cargo.
Hipótesis
Antes de comenzar el experimento contesta la siguiente pregunta: ¿En qué categorías se clasifican los siguientes elementos químicos y qué reacción tendrán al calentarse? Escribe tu hipótesis en cada cuadro de texto.
Material de trabajo
- Revisa todas las sustancias y elige una de ellas.
-
Conoce todo el material haciendo clic sobre los elementos y lleva a la mesa lo que sigue:
- Vaso de precipitado de 30 ml.
- Tubos de ensayo
- Gotero
- Mechero de bunsen
- Piseta con agua destilada
- Indicador universal
- Arrastra el material necesario de acuerdo con la sustancia que elegiste.

Es un frasco con pico y contenedor de sustancias líquidas. En este experimento se empleará para el agua destilada que es H2O a la cual se le han eliminado impurezas e iones (cloruros, calcio, magnesio y fluoruros) mediante la destilación. El agua destilada carece de conductividad a diferencia del agua de uso diario.

Sirve para someter a fuego directo pequeñas cantidades de diversas sustancias, ya que su material soporta elevadas temperaturas.

Es una lámina plana de metal, cerámica o plástico con mango para su manejo. Empleada principalmente para sacar sustancias de frascos.

Pinzas para sujetar los recipientes de porcelana u otros materiales y sustancias.

Sirve para medir volúmenes de líquidos, así como para calentar y mezclar sustancias.

Como su nombre lo indica se utilizan para efectuar pequeños ensayos de reacciones. También se emplean para calentar o mezclar pequeñas cantidades de sustancias líquidas. La gradilla se emplea para sostenerlos, ésta puede ser de metal, madera o plástico.

Se utiliza para llevar a cabo combustiones de pequeñas cantidades de reactivos en el laboratorio. Usualmente se utiliza con el trípode y la rejilla de asbesto.

Los indicadores químicos, como el indicador universal, son sustancias que se utilizan en cantidades muy pequeñas que provocan un cambio de color para determinar las variaciones de pH.

Es un tubo hueco que sirve para la extracción de líquidos por succión a través de una goma en la parte superior.
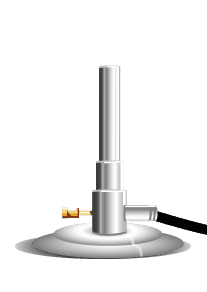
Es un instrumento para calentar sustancias a través de la combustión de una mezcla de gases

Es un anillo de hierro con tres patas que sirve principalmente para sostener recipientes sobre el fuego, usualmente se emplea con la rejilla de asbesto, siendo una malla de hierro de un fino regular con un círculo de asbesto en el centro, ésta se usa cuando no se requiere calentamiento a fuego directo.

Se utiliza para contener líquidos, mezclar y calentar diversos compuestos o mezclas.

Dependiendo de su tamaño permiten tapar tubos de ensayo y diversos tipos de matraces.

Es un elemento químico metálico alcalino blando, aceitoso, de color plateado, que no se encuentra de forma libre en la naturaleza, pero está presente en la sal marina y el mineral halita.
Además de encontrarse en la sal de común (NaCl) necesaria para la vida, el sodio metálico se emplea en síntesis orgánica como agente reductor. Sirve en la fabricación de desodorantes y de celdas fotoeléctricas, en la purificación de metales fundidos, mientras que los óxidos (Na2O) generados por combustión controlada sirven para intercambiar el dióxido de carbono por oxígeno en espacios cerrados como los submarinos.

El potasio es un elemento químico metálico alcalino de color blanco plateado y suave. Es un constituyente esencial para el crecimiento vegetal y se encuentra en la mayoría de los suelos, pero no se encuentra de forma libre en la naturaleza. Se obtienen por electrólisis.
Es un elemento vital en la dieta humana, pero además, los fertilizantes lo contienen usualmente como cloruro (KCl), sulfato (K2SO4) o nitrato (KNO3). El hidróxido de potasio (KOH) es usado en la preparación de detergentes líquidos. El nitrato de potasio (KNO3) y el clorato de potasio (KClO3) son usados en los fuegos artificiales

Es un elemento químico metálico, alcalinotérreo, de color blanco plateado, ligero, medianamente fuerte, que no se encuentra de forma pura en la naturaleza. En forma pulverizada es extremadamente inflamable.
En la medicina, se emplea el cloruro, el hidróxido o leche de magnesia (Mg(OH)2) y el sulfato o sales Epsom (MgSO4). El polvo de carbonato de magnesio (MgCO3) es utilizado por gimnastas y levantadores de pesas para mejorar el agarre de los objetos. Otros usos incluyen: flashes fotográficos, pirotecnia y bombas incendiarias, debido a la luz que despide su combustión.
Las aleaciones de magnesio, especialmente magnesio-aluminio, se emplean en componentes de automóviles, en llantas y en maquinaria diversa, así como en envases de bebidas. Además, el metal se adiciona para eliminar el azufre del acero y del hierro.
En el laboratorio necesitarás las pinzas de crisol para manejarlo.

El calcio es un elemento químico metálico alcalinotérreo color gris plateado bastante duro y que se encuentra dentro de los seres vivos, siendo un metal abundante contenido en minerales como la piedra caliza, yeso y fluorita.
El calcio es la base de la industria del cemento, pero también está presente en muchos productos lácteos o medicamentos para el refuerzo de los huesos humanos. Funciona como agente de aleación utilizado en la producción de aluminio, berilio, cobre, plomo y magnesio. Otros usos son el carbonato de calcio (CaCO3) para la preparación de metales tales como el uranio torio, zirconio, etc

Es un elemento químico no metal con un olor característico y de color amarillo o anaranjado. En la naturaleza se puede encontrar en regiones volcánicas y termales. Es un elemento químico esencial para todos los organismos y necesario para muchos aminoácidos y también para las proteínas.
Se usa principalmente como fertilizante y en la fabricación de pólvora, laxantes, cerillas e insecticidas.

El carbono es un elemento químico no metal puede encontrarse en la naturaleza en distintas formas alotrópicas, carbono amorfo y cristalino en forma de grafito o diamante. Es el pilar básico de la química orgánica y forma parte de todos los seres vivos conocidos.
Es constituyente de los hidrocarburos del petróleo, con sus polímeros se hacen los plásticos, además es componente de la celulosa que es un polímero producido por las plantas, mientras que entre los polímeros con carbono de origen animal están la seda y lana. Se usa como lubricante, como pigmento, como electrodo, en los lápices y en muchas otras sustancias naturales y sintéticas.
Preparación del experimento
- Prepara la disolución.
- Toma una pequeña porción de la sustancia y ponla en la cápsula.
- Coloca la cápsula de porcelana sobre la rejilla de asbesto.
- Prende el mechero.
- Prepara la disolución.
- Toma una pequeña porción de la sustancia y ponla en la cucharilla
- Prende el mechero
- Coloca la cucharilla en la llama
- Recuerda que en el proceso de oxidación deberás recolectar el gas en el matraz y taparlo.
- Prepara la disolución.
- Prende el mechero
- Con las pinzas toma la cinta de magnesio
- Coloca la cinta de magnesio en la llama.
Preparación de la solución
Obtención de óxidos
Vista macroscópica
Vista molecular
Verificación
Vista molecular
- Coloca la cápsula en la mesa cuando se enfríe.
- Deposita la sustancia en el vaso de precipitado.
- Vacía la sustancia en un tubo de ensayo.
- Verifica el color de la sustancia en la escala de Ph.
- Destapa el matraz, vierte en él la disolución del vaso, tápalo, agítalo y destápalo
- Vacía la sustancia en un tubo de ensayo.
- Verifica el color de la sustancia en la escala de Ph.
- Coloca el MgO en el vaso de precipitado.
- Vacía la sustancia en un tubo de ensayo.
- Verifica el color de la sustancia en la escala de Ph.
Contrastación de sustancias
Instrucciones: Completa la tabla con los resultados que obtuviste. Recuerda que debes experimentar con un metal y con un no metal.
| Sustancia | Calentamiento (oxígeno del medio ambiente O2) | Agua destilada (H20) | Tipo de sustancia | Indicador Universal | Resultado final |
|---|---|---|---|---|---|
| Sodio (Na) | Metal | Morado | Base | ||
| Magnesio (Mg) | Metal | Morado | Base | ||
| Calcio (Ca) | Metal | Morado | Base | ||
| Potasio (K) | Metal | Morado | Base | ||
| Azufre (S) | No metal | Rojizo | Ácido | ||
| Carbono (C) | No metal | Rojizo | Ácido |
Conclusiones
Anota tus conclusiones acerca de las reacciones que obtuviste, además contrástalas con tu hipótesis y con la respuesta del experto
- Los metales con el oxígeno y el agua
- Los no metales con el oxígeno y el agua
Respuesta del Experto
-
Reacciones de los metales con el oxígeno
Los óxidos metálicos son producto de la combinación del metal cuando se someten a calentamiento y están en contacto con el oxígeno del medio ambiente.
En este experimento se produjeron óxido de sodio, Na2O; óxido de potasio, K2O; óxido de calcio, CaO y óxido de magnesio, MgO.
Estos óxidos metálicos al combinarse con agua, generan por síntesis las bases o hidróxidos correspondientes como fueron hidróxido de sodio NaOH; hidróxido de potasio KOH; hidróxido de calcio Ca(OH)2 e hidróxido de magnesio Mg(OH)2. -
Reacciones de los no metales con el oxígeno
Los óxidos no metálicos son producto de la combinación de un no metal cuando se somete a calentamiento y están en contacto con el oxígeno del medio ambiente. En este experimento se produjeron óxido de azufre (IV), SO2 y óxido de carbono (IV), CO2.
Estos óxidos no metálicos al combinarse con agua generan por síntesis los ácidos del tipo oxácidos, porque en su composición presentan oxígeno y la calidad ácido proporcionado por la presencia de protones hidrógeno. En esta actividad experimental se sintetizaron ácido sulfuroso, H2SO3 y ácido carbónico, H2CO3.
Hipótesis

Química I
Unidad 2. "Oxígeno, componente activo del aire"
Tema: Acción del oxígeno del aire sobre los elementos.
Hipótesis:
Sustancias metálicas:
Sustancias no metálicas:
Conclusiones:
1. Los metales con el oxígeno y el agua.
2. Los no metales con el oxígeno y el agua.


Contrastación de sustancias
| Sustancia | Tipo de sustancia | Calentamiento (oxígeno del medio ambiente O2) | Agua destilada (H20) | Indicador Universal | Resultado final |
|---|

Tabla de contrastación
Limpieza
Después de realizar cualquier experimento limpia tu área de trabajo, así como el instrumental y material utilizado. Se sugiere especialmente si se trabajó con sustancias de riesgo para la salud. En este caso deberás seguir los siguientes pasos:
- Neutraliza los hidróxidos producidos combinándolos con los ácidos que formaste. Al reaccionar los hidróxidos con los ácidos se produce una sal y agua.
- Vierte al lavabo las sales producidas y lava tus materiales.
- Entrega todos los materiales limpios a tu laboratorista.
- Limpia con un trapo húmedo el área de trabajo y lávalo para su uso posterior. Es importante no dejar residuos corrosivos.
Conclusiones
¿Cuáles son las características
de los metales y no metales ?
| Característica | Metales
Ver ejemplo |
No metales
Ver ejemplo |
|---|---|---|
| Brillo |
Tienen brillo
|
Son opacos
|
| Maleabilidad |
Se pueden convertir en láminas delgadas
|
No se pueden convertir en láminas delgadas
|
| Ductibilidad |
Se pueden convertir en hilos
|
No se pueden convertir en hilos
|
| Conductor de calor y electricidad |
Son excelentes conductores de electricidad y calor
|
Son aislantes o semiconductores
|
| Tenacidad |
Son duros y resistentes
|
Son frágiles y quebradizos
|
| En contacto con 02 |
Forman óxidos básicos
|
Forman óxidos ácidos
|
| Ejemplo de elemento |
Na(Sodio)
|
S(Azufre)
|
Para visualizar correctamente éste contenido es necesario alguna de las siguientes versiones de navegador:
- Internet Explorer 9 o superior
- Firefox 14 o superior
- Chrome 21 o superior
- Safari 5.1 o superior
- Opera 12 o superior
